|
|
|
|
|
|
|
|
 |
|
|
|
|
 |
|
|
|
|
|
2026.1.5 |
|
no.82
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
機能性表示食品の見直し |
| |
| |
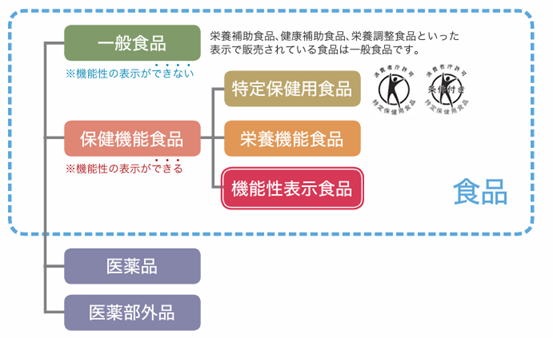
| 1.機能性表示食品とは |
| 機能性表示食品制度とは、国の定めるルールに基づき、事業者が食品の安全性と機能性に関する科学的根拠などの必要な事項を、販売前に消費者庁長官に届けることにより、特定の保健目的(疾病リスク低減に係るものを除く)が期待できる表示が可能となる制度です。2015年にスタートし、10年間で6,000件以上の届け出があり、1991年にスタートした特定保健用食品の1,000件の許可を大きく上回っています。 |
| |
 |
| 消費者庁資料 |
| |
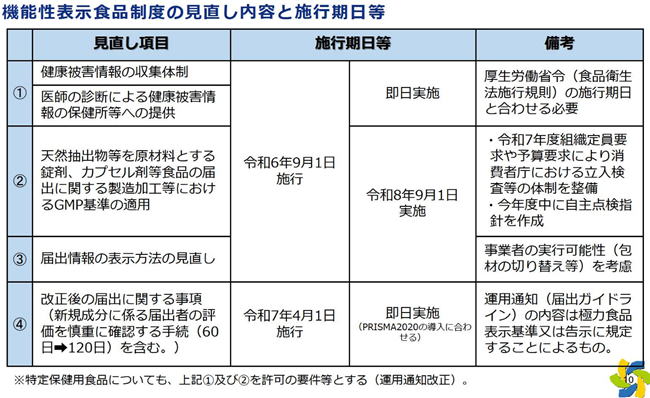
| 2.機能性表示食品の見直しの概要 |
| 2024年3月に発生した小林製薬の紅麹原料を含む機能性表示食品において健康被害が生じていることを踏まえ、今回の事案を受けて機能性表示食品制度の今後の在り方を検討する「機能性表示食品を巡る検討会」が4月に立ち上がり、2か月の短期で検討を進めた結果、以下の見直しが決定されました。 |
| |
 |
| 消費者庁資料 |
| |
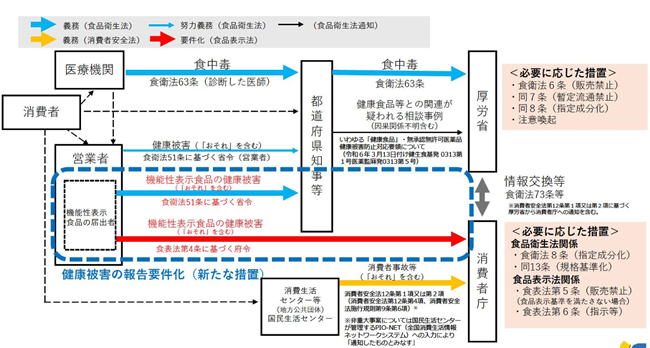
| 3.健康被害情報の収集体制の強化 |
| 機能性表示食品の届出者は、健康被害と疑われる情報を収集し、健康被害と疑われる情報(医師が診断したものに限る。)を把握した場合は、当該食品との因果関係が不明であっても速やかに消費者庁長官及び都道府県知事等に情報提供することが義務付けられました。 |
| |
 |
| 消費者庁資料 |
| |
| 4.GMPの義務化 |
製造工程管理による製品の品質の確保を徹底する観点から、機能性表示を行うサプリメント(天然由来の抽出物であって分画、精製、化学的反応等により本来天然に存在するものと成分割合が異なっているもの又は化学的合成品を原材料とする錠剤、カプセル剤、粉末剤、液剤等の形状である食品を指す。)についてはGMPに基づく製造管理は義務化されました。
GMPの義務化に関しては、届出者が自主点検をするとともに、2026年9月1日以降、消費者庁が必要な体制を整備した上で食品表示法に基づく立入検査等を行うこととなっています。 |
| |
 |
| 消費者庁資料 |
| |
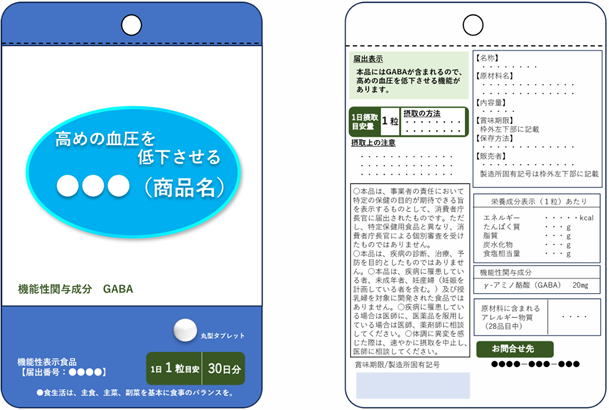
| 5.表示方法の見直し |
| 機能性表示食品が特定保健用食品(トクホ)と異なり安全性及び機能性について国による評価を受けた食品ではない旨、医薬品とは異なり疾病の治療、予防を目的としたものではない旨、また、摂取上の注意事項として、医薬品等との相互作用や過剰摂取防止のための注意喚起を具体的に記載する等、表示の方法や表示位置などの方式を見直しました。 |
| |
| 従前 |
 |
| 消費者庁資料 |
| |
| 改正後 |
 |
| 消費者庁資料 |
| |
| |